Malaria
Pur non essendo più endemica in Italia, la malaria rappresenta tuttora la più importante malattia d'importazione anche nel nostro Paese, a causa del numero crescente di viaggiatori provenienti da aree endemiche.
AGENTE CAUSALE E CICLO INFETTIVO
Il nome malaria deriva dall'antica convinzione che si potesse contrarre questa malattia dalle "male arie", ossia i miasmi malsani emanati dalle acque stagnanti delle paludi. In questa credenza c'era del vero, ossia lo stretto legame della malattia con le aree palustri, ma oggi sappiamo che il collegamento tra queste e la malattia è da ricercare in una coppia di organismi viventi: la zanzara e il plasmodio.
In realtà, quando si parla genericamente di malaria si sottintendono varie patologie, simili ma diverse per sintomi, gravità e agenti causali. Questi ultimi sono rappresentati da diverse specie di Protozoi parassiti della classe degli Sporozoi, tutti del genere Plasmodium, ognuno dei quali può causare una o più peculiari forme della malattia. I più comuni plasmodi patogeni per l'uomo sono: Plasmodium falciparum, agente della cosiddetta terzana maligna (la forma più grave), P. vivax e P. ovale (specie che per alcuni Autori va suddivisa in due specie distinte, P. ovale curtisi e P. ovale wallikeri, utilizzando una nomenclatura trinomia per ridurre la confusione che si genererebbe eliminando il termine "ovale" in un organismo clinicamente così importante), agenti di due forme di terzana benigna, e P. malariae, agente della quartana. Anche P. knowlesy, che ha come serbatoi alcuni primati delle foreste del Borneo e della Malesia, può causare, sebbene raramente, una forma di malaria nell'uomo, detta "quotidiana". Il serbatoio dei quattro più comuni plasmodi è, invece, rappresentato da popolazioni umane in cui la malattia è cronicizzata.
I vettori sono una sessantina di specie di zanzare ad attività crepuscolare-notturna (anche se in ogni area geografica ci sono solo 3-4 specie in grado di trasmettere la malattia), tutte appartenenti al genere Anopheles. Zanzare appartenenti ad altri generi non sono in grado di trasmettere questi parassiti (mentre possono trasmettere virus, batteri e microfilarie). Ma anche tra le Anopheles non tutte possono fungere da vettore. Per poterlo essere, innanzitutto, ci deve essere perfetta concordanza temporale tra il cosiddetto ciclo gonotrofico della zanzara (pasto di sangue, maturazione e deposizione delle uova, nuovo pasto di sangue) e quello di sviluppo del plasmodio nella zanzara stessa. E' poi necessario che la zanzara abbia un elevato grado di antropofilia, intesa come alta probabilità che essa compia il successivo pasto su un umano (ad esempio An. gambiae, uno dei principali vettori africani, ha un grado di antropofilia tra l'80 e il 100%). Infine, anche se una zanzara può essere un potenziale vettore, perché inneschi un ciclo epidemico è necessario che sia presente con una certa densità e che vi sia un sufficiente numero di soggetti umani infetti da cui "approvvigionarsi" di plasmodi, condizione che non si verifica più in molte aree del globo, tra cui l'Europa, gran parte dell'Asia e l'America settentrionale, dove queste specie permangono in aree di cosiddetto "anofelismo residuo". Qui, l'introduzione di plasmodi, attraverso viaggiatori di ritorno da aree endemiche, può provocare la comparsa di sporadici casi autoctoni, sempre che le zanzare presenti siano competenti per il plasmodio in questione. La malaria si contrae, infatti, solo in seguito alla puntura di una femmina infetta appartenente a una delle specie competenti per la trasmissione di un dato plasmodio. Questa si deve essere, a sua volta, infettata suggendo il sangue da un soggetto malarico in fase infettiva e prima che possa, a sua volta, infettare un soggetto sano, il plasmodio deve completare una parte del suo ciclo di sviluppo all'interno della zanzara stessa. Questo ciclo può durare da una settimana a quasi un mese, a seconda della specie plasmodiale e della temperatura ambientale.
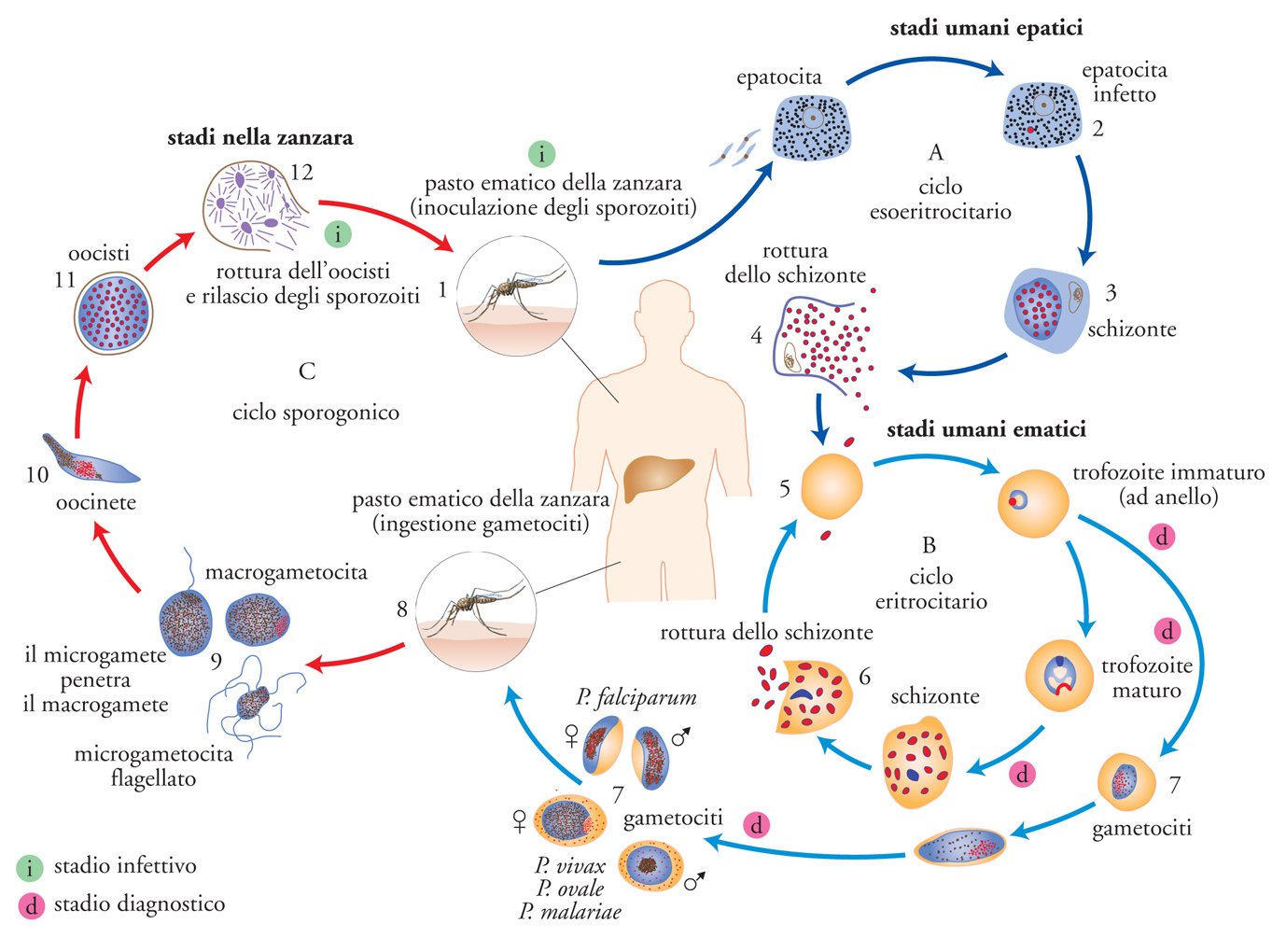
Il ciclo biologico della malaria (fonte: Enciclopedia della Scienza e della Tecnica, 2007)
Quando una zanzara punge l'uomo, gli inocula con la propria saliva i plasmodi al loro stadio terminale di evoluzione nella zanzara, chiamati sporozoiti. Entro un'ora dalla puntura, gli sporozoiti infettano le cellule del fegato (epatociti) dove si moltiplicano instaurando un ciclo detto esoeritrocitario, trasformandosi prima in trofozoiti e poi in schizonti (cellule plurinucleate). Il ciclo epatico dura tra 6 e 16 giorni, a seconda delle specie di plasmodio. Da ogni schizonte si originano, per rottura dello stesso, da 10.000 a 30.000 merozoiti, che si riversano nel torrente circolatorio dove infettano i globuli rossi dando inizio al ciclo eritrocitario. Poche ore dopo questa invasione, i plasmodi sono evidenziabili al microscopio con la loro caratteristica forma ad anello di trofozoita immaturo. Verso la fine dello stadio anulare comincia a evidenziarsi un vacuolo digestivo, all'interno del quale compaiono finissimi granuli di emozoina, il pigmento terminale derivato dall'emoglobina dei globuli rossi di cui si sono nutriti. Il vacuolo digestivo e la quantità di pigmento aumentano col crescere del parassita, che in questa fase prende il nome di trofozoita. Dopo successive divisioni nucleari, il vacuolo digestivo si ritrova al centro di un nuovo schizonte con attorno dei merozoiti, a formare una rosetta. A questo punto i globuli rossi si rompono, liberando nel sangue i merozoiti e le sostanze pirogene che causano un primo attacco febbrile. Alcuni merozoiti infettano altri globuli rossi, ripetendo ciclicamente il processo e gli attacchi febbrili. Altri merozoiti si trasformano invece in elementi sessuati, maschili e femminili, detti gametociti. Se a questo punto una zanzara competente punge il malato, aspirerà i gametociti con il suo sangue. Nella zanzara, i gametociti maschili si divideranno diverse volte, trasformandosi in microgametociti flagellati e quindi mobili. I gametociti femminili sono, invece, più grandi (macrogametociti) e immobili. Quando un microgametocita penetra in un macrogametocita si produce uno zigote che presto cambia forma, diventando un oocinete, allungato e mobile. Questo penetra nella parete dello stomaco della zanzara, si fissa sulla tunica esterna formando un'oocisti, che si sviluppa e cresce di dimensioni, contenendo all'interno migliaia di sporozoiti. La rottura dell'oocisti libera nella cavità addominale della zanzara gli sporozoiti che migrano verso le ghiandole salivari all'interno delle quali penetrano e permangono in attesa che la zanzara punga un altro individuo, ripetendo nuovamente il ciclo.
Nel caso del P. falciparum, il ciclo eritrocitario inizia dopo circa una settimana dall'inizio del ciclo epatico e si compie ogni 48 ore, provocando accessi febbrili ricorrenti tipicamente ogni terzo giorno (malaria terzana maligna), similmente alla malaria provocata da P. vivax e P. ovale, dove però l'infezione è meno grave (malaria terzana benigna). Invece, nel caso del P. malariae, il ciclo eritrocitario inizia dopo circa due settimane, ha un periodo di 72 ore e gli attacchi malarici sono ogni quarto giorno (malaria quartana). P. knowlesi ha un ciclo più breve, di appena 24 ore, da cui il nome di "malaria quotidiana" dato alla malattia che esso provoca nell'uomo. Nelle infezioni da P. vivax rimangono nel fegato delle forme dormienti, dette ipnozoiti, che possono scatenare delle recidive anche a distanza di anni. P. malariae può, invece, dare recrudescenze per via di forme che rimangono vitali nel circolo ematico, evadendo le difese immunitarie e causando un nuovo accesso malarico quando queste si abbassano.
SINTOMI E DECORSO DELLA MALATTIA
La malattia può assumere diverse forme, a seconda del plasmodio coinvolto, delle condizioni e dell'età del soggetto colpito. I sintomi compaiono dopo la fase epatica, in genere asintomatica, quando i parassiti completano il primo ciclo di riproduzione asessuata nei globuli rossi.
L’attacco malarico si presenta inizialmente con cicli di brividi, febbre e sudorazione profusa, ogni uno, due o tre giorni a seconda della specie. In stadi avanzati la febbre può diventare irregolare o continua. Nausea, vomito, diarrea e dolori addominali possono accompagnare gli stati febbrili.
Negli adulti che vivono in zone endemiche, con adeguata immunità innata o acquisita, l'infezione può essere asintomatica o facilmente curabile. Si parla in questo caso di malaria non complicata. Nei soggetti non immuni, nei bambini e nelle donne in gravidanza, la malaria da P. falciparum, e talvolta anche da P. vivax, può presentarsi come severa, con anemia grave o infezione cerebrale, spesso fatali.
L’anemia, di tipo emolitico, può essere molto grave, ed è causata dalla perdita di globuli rossi, sia per lisi di quelli infetti, sia per l’accelerata senescenza di quelli non infettati che vengono eliminati nella milza. Anche quelli eventualmente trasfusi sono distrutti rapidamente. La milza spesso si presenta tumefatta e, contenendo molti parassiti, può diventare tanto fragile da subire rotture. Altra peculiarità della malaria da P. falciparum è il fenomeno della citoaderenza, in cui i globuli rossi infetti aderiscono alle pareti dei capillari di vari organi, tra cui polmoni, reni e cervello, causando rallentamento del flusso sanguigno e occlusioni tali da portare a ischemie. Queste conseguenze sono particolarmente gravi a livello cerebrale (malaria cerebrale) con perdita di conoscenza, edema cerebrale, coma e spesso morte.
Nell'Africa sub-sahariana la mortalità per malaria cerebrale può raggiungere il 20% nei bambini sotto i 5 anni di età, anche se trattati farmacologicamente, ed è fatale nella maggior parte dei casi non trattati.
Oltre che per la citoaderenza, la malaria da P. falciparum risulta essere più grave perché vengono infettati globuli rossi di tutte le età. P. vivax e P. ovale infettano, invece, prevalentemente i giovani reticolociti, mentre P. malariae infetta i globuli rossi senescenti. In queste forme di malaria, meno gravi, la mortalità è spesso dovuta al cedimento della milza o a danni renali. Recenti diagnosi più accurate hanno, tuttavia, rivelato un numero di casi di malaria grave da P. vivax più elevato di quanto si pensasse un tempo.
P. knowlesi presenta un ciclo schizogonico ematico di 24 ore, causando in genere una forma non complicata e sensibile al trattamento con clorochina. Tuttavia, sono state descritte diverse forme gravi, le cui complicanze più comuni sono insufficienza respiratoria, disfunzione epatica e insufficienza renale, con una mortalità intorno al 2% dei casi.
TRATTAMENTO E PREVENZIONE
Il primo e, per molto tempo, unico rimedio utilizzato con efficacia per il trattamento della malaria è stato l'estratto di corteccia di Cinchona officinalis, usata in Perù nella medicina tradizionale e importata in Europa dai gesuiti all'inizio del XVII secolo. Nell'800, due chimici francesi, Pellitier e Caventou, riuscirono a estrarre dalla corteccia il principio attivo, un alcaloide chiamato chinino, sintetizzato solo dal 1929. Nonostante i suoi pesanti effetti collaterali, il chinino è tuttora in uso per la cura della malaria cerebrale. A causa della ridotta possibilità d'importazione in Europa della corteccia di Cinchona officinalis durante la prima guerra mondiale, si ripresero gli studi iniziati da Paul Erlich del 1891 sull'attività antimalarica del blu di metilene, sulla cui struttura chimica vennero sintetizzate nuove sostanze antimalariche, tra cui pamachina, primachina e mepacrina. Fu sempre a causa di una guerra che negli anni '40, per proteggere le truppe americane impegnate nel Pacifico, vennero sintetizzate clorochina, amodiachina, proguanil e pirimetamina. La clorochina, in particolare, per l'efficacia e il basso costo, ha avuto un impiego generalizzato per moltissimi anni, finché intorno al 1970 hanno incominciato a emergere e diffondersi ceppi di plasmodio resistenti. E ancora una volta fu una guerra, quella del Vietnam, a portare da un lato gli scienziati americani a sviluppare nuovi composti modificando la struttura del chinino (nacque così la meflochina) e dall'altro i colleghi cinesi a studiare i prodotti della loro medicina tradizionale trovando nell'estratto di Artemisia annua un nuovo principio attivo, l'artemisinina, chimicamente diverso dagli altri antimalarici in uso, molto efficace e sicuro. Sulla struttura chimica di questa molecola vennero elaborati nuovi principi attivi, quali artesunato, artemetere e arteetere.
Negli stessi anni, sempre l’esercito americano, sintetizzò l’alofantina, principio attivo non registrato in Italia. L'alofantrina non serve come profilassi e non deve essere assunta da chi ha fatto profilassi con meflochina o l'ha comunque assunta negli ultimi due mesi, né da chi ha assunto chinino o chinidina nelle ultime 48 ore.
Nel 2007 è stato studiato come antimalarico il propranololo, un betabloccante utilizzato contro l’ipertensione che riesce anche ad impedire ai plasmodi di penetrare nei globuli rossi e potrà essere usato in associazione con altri farmaci antimalarici, consentendo di ridurne notevolmente le dosi di assunzione.
Nel 2018, infine, è stato registrato negli USA un medicinale a base di taferochina, simile alla primachina, per abbattere i casi recidivi di malaria da P. vivax resistenti a clorochina e primachina.
Attualmente ci sono quindi a disposizione farmaci a base di aril-amino alcoli (chinino, meflochina, lumefantrina), le aminochinoline (clorochina, amodiachina, taferochina), i sulfamidici (sulfadossina-pirimetamina o S/P), alcuni antibiotici (doxiciclina) e betabloccanti (propranololo), i fenantrenici (alofantrina), i derivati dell'artemisinina (diidroartemisinina, artemetere, arteetere, artesunato, artemisone) e l'atovaquone, usato in combinazione con il proguanil come profilassi sotto il nome di Malarone®.
L'attività farmacologica dei derivati di artemisinina è diretta specialmente contro le forme asessuate intra-eritrocitarie di tutte le specie di plasmodio. In particolare, sono gli unici schizonticidi che uccidono le forme giovani, i cosidetti "anelli" e anche i primi stadi di sviluppo dei gametociti. I derivati di artemisinina agiscono molto più rapidamente rispetto a qualsiasi altro farmaco antimalarico conosciuto ma hanno un'emivita molto breve, che non permette di contrastare eventuali ricadute a 3-4 settimane. Per questo sono utilizzati in combinazione con altri farmaci nelle cosiddette terapie combinate a base di artemisinina (ACT).
Per il trattamento della malaria non complicata da P. falciparum, che ha lo scopo di eliminare il parassita più velocemente possibile per evitare che la malattia si evolva nella forma severa e per impedire lo sviluppo delle forme sessuate nell’uomo (ossia quelle infettive), l'OMS consiglia le ACT per aumentare l'efficacia dell'artemisinina e ridurre il rischio d'insorgenza di resistenza (purtroppo già in atto, anche verso ATC). Sono, ad esempio, in commercio farmaci a base di artemetere e lumefantrina (Coartem® e Riamet®), artesunato e amodiachina, artesunato e meflochina, artesunato e S/P o diidroartemisinina e piperachina (Eurartesin®).
L’OMS raccomanda in questi casi di iniziare la terapia solo dopo confermata diagnosi di malaria, di non usare i derivati di artemisinina da soli e di completare i tre giorni di terapia. Nelle aree endemiche, specialmente quelle a bassa trasmissione, si consiglia di aggiungere una singola dose di primachina come farmaco antigametocita, in grado di bloccare la trasmissione del plasmodio al vettore. Per le infezioni da P. vivax si può usare la clorochina, laddove il parassita sia ancora suscettibile a questo farmaco, viceversa si usa anche in questo caso un'ACT.
Una cura atta a debellare gli ipnozoiti di P. vivax dormienti nel fegato, richiede tuttavia un trattamento di due settimane con primachina.
Nel caso della malaria severa da P. falciparum, l'obiettivo principale del trattamento è di riuscire a salvare il paziente e, nel caso si tratti di malaria cerebrale, di prevenire i danni neurologici a essa spesso associati. A tal fine, va trattata al più presto con qualsiasi farmaco efficace a disposizione. In questi casi l'artesunato IV si è dimostrato superiore al chinino sia in Asia sia in Africa, ma non è registrato in Europa.
A coloro che, provenendo da aree non endemiche, devono soggiornare per brevi periodi in aree endemiche per turismo, lavoro o volontariato, è vivamente consigliato un trattamento profilattico antimalarico in quanto, non essendo coperti da immunità innata o acquisita, sono a rischio di contrarre la forma severa della malattia. Anche se non esiste alcuna profilassi farmacologica in grado di garantire una protezione al 100% è necessario valutare con il proprio medico o con uno specialista di medicina dei viaggi quale prodotto scegliere, a seconda della meta, del proprio stato di salute, del grado di tollerabilità del proprio organismo ai vari principi attivi ecc. I farmaci più comunemente suggeriti sono meflochina, doxiciclina e malarone. La meflochina (Lariam®) è un farmaco ad azione schizonticida rapida, con effetto anche sui gametociti di P. vivax e P. malariae (ma non su quelli di P. falciparum). L'uso di meflochina può causare effetti collaterali, quali disturbi digestivi e a carico del sistema nervoso centrale. Anche la già citata associazione tra atovaquone e proguanil (Malarone®) è utilizzata per la profilassi. Ha una potente azione schizonticida ed è attiva anche contro le forme epatiche di P. falciparum (ma non contro gli ipnozoiti di P. vivax) e pertanto va presa fino a una settimana dopo il rientro.
L'altro cardine per prevenire l'infezione nei Paesi a rischio, tanto per i viaggiatori, quanto per i residenti, è la protezione nei confronti del vettore. Un'adeguata protezione nei confronti delle punture d'insetto consente, infatti, di ridurre del 90% il rischio di contrarre la malaria. Nella maggior parte dei casi le zanzare malarigene tendono a pungere dall'imbrunire, quando l'intensità dei raggi solari si riduce. E' soprattutto in questi momenti che è essenziale che i viaggiatori mettano in atto tutte le misure per impedire il contatto con l'insetto:
- evitare, se possibile, di soggiornare all'aperto nelle ore in cui le zanzare anofele sono attive;
- indossare abiti di colore chiaro (i colori scuri e quelli accesi attirano gli insetti), con maniche lunghe e pantaloni lunghi che coprano la maggior parte del corpo, in particolare dopo il tramonto;
- utilizzare un repellente per insetti: i repellenti possono essere applicati sulla pelle esposta (o sui capi di abbigliamento) e dovrebbero contenere DEET (dietiltoluamide) o IR3535 o Icaridina che sono gli ingredienti biologicamente attivi più comuni ed efficaci. I repellenti devono essere utilizzati in stretta conformità con le istruzioni riportate sull'etichetta;
- soggiornare preferibilmente in stanze dotate di condizionatore d'aria oppure, in alternativa, di zanzariere a porte e finestre, verificando che queste siano in buono stato e ben chiuse;
- se si trascorre la notte in ambienti privi delle suddette protezioni, si consiglia l'uso di zanzariere da letto, rimboccandone i margini sotto il materasso e controllando che nessuna zanzara sia rimasta imprigionata all'interno. Qualora necessario può risultare molto utile impregnare le zanzariere con insetticidi a base di piretroidi.
Se, nonostante tutte le precauzioni adottate, si sospetta di aver contratto la malaria (o altre malattie) durante un viaggio in Paesi a rischio, bisogna immediatamente fare riferimento a una struttura che abbia la possibilità e le capacità di fare una diagnosi accurata.
Da molti anni si stanno studiando e sperimentando possibili vaccini in grado di proteggere dall'infezione ma ancora nulla è arrivato sul mercato. Il primo vaccino a superare tutte le prove preliminari è il cosiddetto RTS,S/AS01, che ha mostrato una parziale protezione contro la malaria da P. falciparum nei bambini. In studi clinici su larga scala tra i bambini di 5-17 mesi che hanno ricevuto 4 dosi, il vaccino è riuscito a prevenire circa 4 casi su 10 di malaria per un periodo di 4 anni. A causa di questa protezione parziale, l’RTS,S/AS01 potrà affiancare ma non sostituire gli altri metodi di lotta. L'OMS ha dato inizio nell'aprile del 2019 a un test su più ampia scala che prevede l'introduzione graduale del RTS,S/AS01 nel programma vaccinale di 3 Paesi dell'Africa sub-sahariana (Malawi, Ghana e Kenya) arrivando a vaccinare fino a 360.000 bambini l'anno. Il test permetterà di capire l'efficacia del vaccino in contesti reali, il modo migliore per fornire le 4 dosi in cui è suddiviso, la sua sicurezza nell'uso di routine e il ruolo potenziale che può avere nel ridurre le morti infantili.
Un secondo vaccino recentemente raccomandato dall’OMS, per la prevenzione della malaria nei bambini, è il 21/Matrix-M.
Entrambi i vaccini hanno dimostrato di essere sicuri ed efficaci nel prevenire la malaria nei bambini e, se implementati su larga scala, si prevede che avranno un impatto elevato sulla salute pubblica.
Un'altra importante forma di prevenzione è costituita dalla lotta al vettore. Gli interventi per la riduzione della densità delle zanzare vengono effettuati mediante trattamenti con insetticidi ad azione residua all'interno delle abitazioni, con la riduzione dei focolai larvali mediante bonifiche ambientali e con l'uso di prodotti larvicidi o di predatori naturali di larve di zanzare.
La comparsa della resistenza agli insetticidi più in uso è da tempo motivo di forte preoccupazione per le autorità sanitarie mondiali. Ad oggi, oltre 68 Paesi hanno segnalato resistenza a una o più classi di insetticidi comunemente impiegati per impregnare le zanzariere da letto o i trattamenti residuali nelle abitazioni. L'OMS sottolinea la necessità di sviluppare efficaci strategie di gestione della resistenza agli insetticidi e, nell'attesa dell'immissione sul mercato di nuovi prodotti, l'approccio più efficace per gestire il fenomeno della resistenza risulta essere la rotazione dei principi attivi esistenti.

Cinchona officinalis. Icones plantarum medico-oeconomico-technologicarum cum earum fructus ususque descriptione, [1800]-1822
IMPATTO DELLA MALATTIA
La popolazione adulta che vive in aree ad elevata densità di trasmissione sviluppa una sorta di immunità parziale o adattativa al plasmodio cui è esposta. Questa forma di immunità, pur non eliminando il rischio di ammalarsi, riduce la possibilità di sviluppare una forma grave. In queste aree, infatti, il maggior numero di decessi si registra tra i bambini sotto i 5 anni. Solo chi sopravvive a questa età riesce a sviluppare la forma di immunità adattativa al plasmodio. La seconda categoria a rischio è costituita dalle donne in gravidanza, poiché il loro stato implica una maggior suscettibilità a sviluppare forme acute della malattia con gravi anemie. Ciò può nuocere gravemente alla crescita fetale e portare alla morte della madre e/o del nascituro.
Dove invece la densità di trasmissione di un plasmodio è bassa, tutta la popolazione presenta lo stesso rischio di sviluppare forme gravi della malattia.
In alcune aree del terzo mondo, fenomeni estremi, come inondazioni, carestie, rivoluzioni, genocidi, drastici cambiamenti ambientali ecc., provocano spesso grandi movimenti migratori, i quali possono a loro volta favorire l'esposizione a un dato parassita di popolazioni ad esso vulnerabili. Trattandosi a loro volta di zone povere, le aree in cui questi migranti giungono mancano molto spesso di efficaci attività di controllo del vettore, di infrastrutture adeguate ad affrontare la malattia e delle risorse necessarie per la sua cura. Tutto ciò porta in breve tempo a gravi epidemie.
La malaria influenza negativamente e in maniera significativa anche l'economia. Nei paesi in cui è largamente diffusa, ampi strati delle popolazioni affette, pur non sviluppando le forme più gravi grazie all'immunità adattativa, non sono infatti in grado di lavorare efficacemente per lunghi periodi, senza contare i gravosi costi sanitari che si devono affrontare per la prevenzione e la cura.
CENNI STORICI E DISTRIBUZIONE ATTUALE
L'origine della malaria è antichissima e verosimilmente riconducibile al continente africano dove, peraltro, ha avuto origine la nostra specie. Studi genetici indicherebbero che uomo e plasmodi, dopo essersi incontrati e coevoluti in Africa, potrebbero addirittura esserne usciti insieme durante le migrazioni umane del Pleistocene. Venendo ai tempi storici, sono molte le testimonianze documentali, epigrafiche e archeologiche riconducili con una certa sicurezza alla malaria: ve ne sono in Cina, in India e, di più recenti, nel bacino del Mediterraneo. Qui, la perizia degli antichi romani nel regimare le acque con opere di bonifica ne rallentò la diffusione, almeno fino a quando la forza dell'impero lo consentì. Negli ultimi secoli dell'età imperiale e in quelli seguenti si propagò intervenendo con forza nelle vicende storiche, facilitando ora invasioni ora opere difensive, decimando interi eserciti e colpendo personaggi famosi.
Recentemente sono emerse testimonianze tali da permetter anche di stabilire il tipo di plasmodio che imperversava in Italia sul finire dell'impero romano: dalla polpa dentale recuperata in resti umani provenienti da due necropoli dell'Italia meridionale (Velia e Vagnari, rispettivamente in provincia di Salerno e Bari) è stato estratto e sequenziato un tratto di DNA mitocondriale inconfutabilmente riconducibile al P. falciparum.
L'analisi genetica di campioni di sangue molto più recenti ha permesso di ricostruire la storia naturale dei ceppi di malaria presenti in Europa occidentale prima della sua eradicazione, avvenuta circa mezzo secolo fa. Già si sapeva che la malaria europea era dovuta a P. falciparum e a P. vivax, ma la loro storia naturale, per esempio le vie seguite dai plasmodi per raggiungere il nostro continente, non era nota, perché i parassiti erano stati eradicati prima dello sviluppo delle tecniche di analisi genetica. Estraendo il DNA mitocondriale dal sangue secco ricavato da vetrini da microscopia preparati oltre 70 anni fa, i ricercatori sono riusciti a ricostruire il 67% del genoma mitocondriale di P. vivax e l'intero genoma di P. falciparum.
Dalle successive analisi è risultato che il P. falciparum europeo era affine agli attuali ceppi indiani, in accordo con quanto si può desumere da resoconti storici secondo cui in India già 3.000 anni fa era diffusa una febbre intermittente con caratteristiche tipiche di una grave forma di malaria. Da lì, circa 500 anni dopo, la malattia sarebbe approdata in Grecia, per poi dilagare in tutte le regioni costiere del Mediterraneo all'inizio dell'era cristiana. Il P. vivax europeo sembra invece discendere da un ceppo ancestrale eurasiatico e sarebbe stato portato in America dagli europei poco dopo la sua scoperta. I ceppi americani di P. falciparum sarebbero, invece, giunti nel Nuovo Continente direttamente dall'Africa, molto probabilmente con la tratta degli schiavi.
Gli attuali areali di diffusione endemica dei quattro principali plasmodi malarigeni sono simili: Africa sub-sahariana, America centro-meridionale, subcontinente indiano, Asia meridionale, alcune zone della Cina e del Mediterraneo, isole e penisole dell'Indopacifico (escluse Australia, Nuova Zelanda e alcune isole minori) con l'eccezione del P. ovale, assente nelle Americhe, nell'area mediterranea e in Asia centrale e sud-occidentale. Quello che cambia nelle diverse aree è la densità relativa dei vari plasmodi. P. falciparum è predominante in Africa, nel sud-est asiatico e nell'Indopacifico, comune in India, Asia centrale e Americhe, dove invece è predominante P. vivax. Questo è praticamente l'unico plasmodio presente nell'area mediterranea ed è comune in Africa orientale, Asia meridionale e Indopacifico. P. malariae è comune in Asia centrale e sud-occidentale e in America del Sud. Raro o molto raro altrove.
Circa la metà della popolazione mondiale è a rischio di malaria. Specifici gruppi di popolazione a rischio includono:
- bambini piccoli che vivono in aree a trasmissione stabile e non hanno ancora sviluppato l'immunità protettiva nei confronti delle forme più gravi della malattia;
- donne incinte in quanto la malaria contratta in gravidanza aumenta il rischio di parti prematuri, aborto, morte neonatale e morte della madre;
- viaggiatori internazionali provenienti da aree non endemiche a causa dell'assenza di immunità;
- immigrati provenienti da aree endemiche e i loro figli, che vivono in aree non endemiche e tornano nei Paesi d'origine in visita ad amici e parenti, sono similmente a rischio a causa del calo o assenza di immunità (I Visiting Relatives and Friends presentano una probabilità 8 volte più elevata di ammalarsi di malaria rispetto ad altre tipologie di viaggiatori).
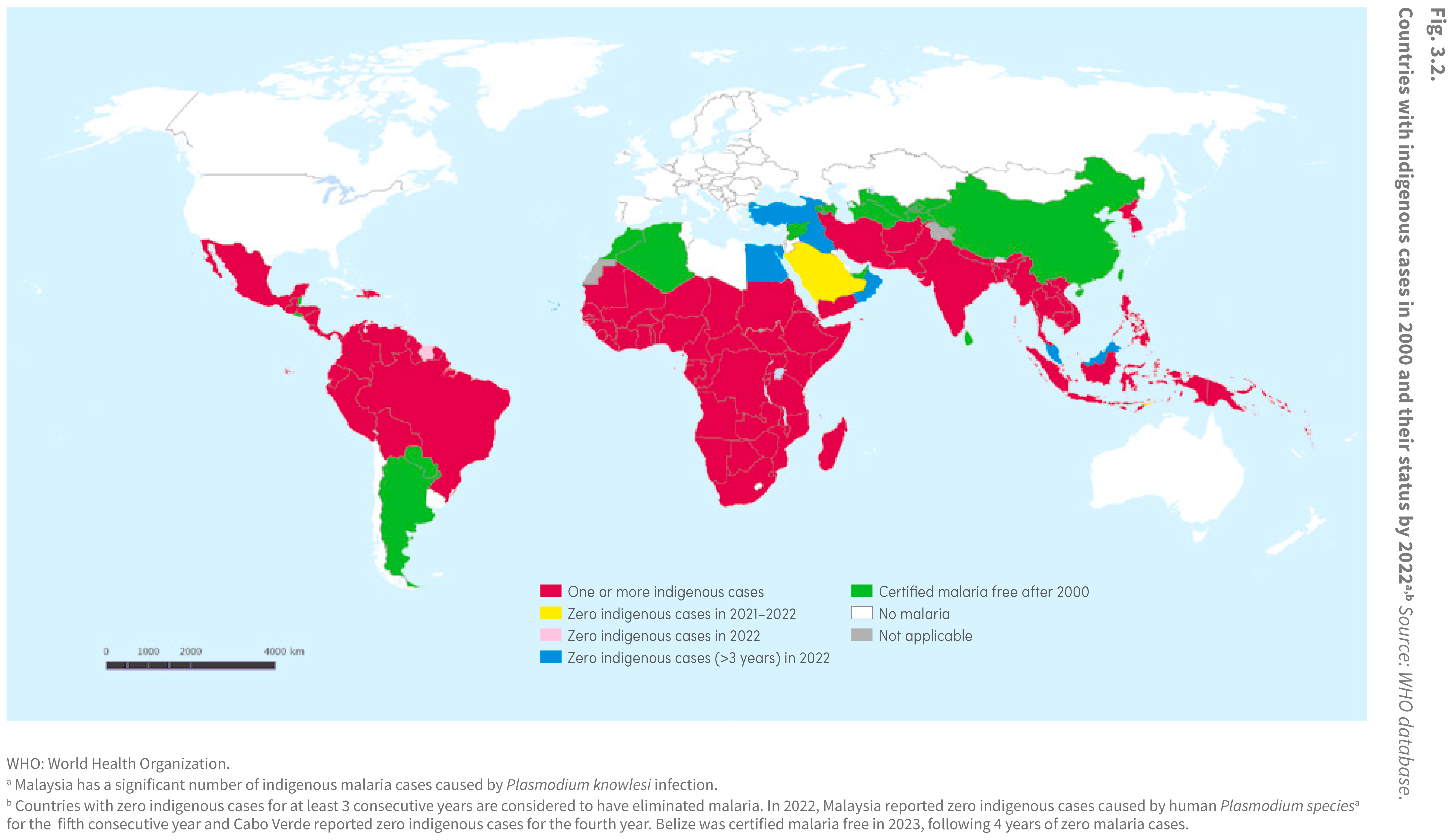
Paesi con casi indigeni nel 2000 e loro status fino al 2022 (Fonte: OMS).
I paesi con zero casi indigeni per almeno 3 anni consecutivi sono considerati tra quelli che hanno eliminato la malaria.
Nel 2022, la Malaysia ha riportato zero casi indigeni causati da plasmodi umani per il quinto anno consecutivo,
anche se ha un significativo numero di casi indigeni di malaria da Plasmodium knowlesi, considerato un plasmodio dei primati non umani.
Capo Verde ha riportato zero casi indigeni per il quarto anno consecutivo.
Il Belize è stato certificato “malaria free” nel 2023 in seguito a 4 anni senza casi di malaria.
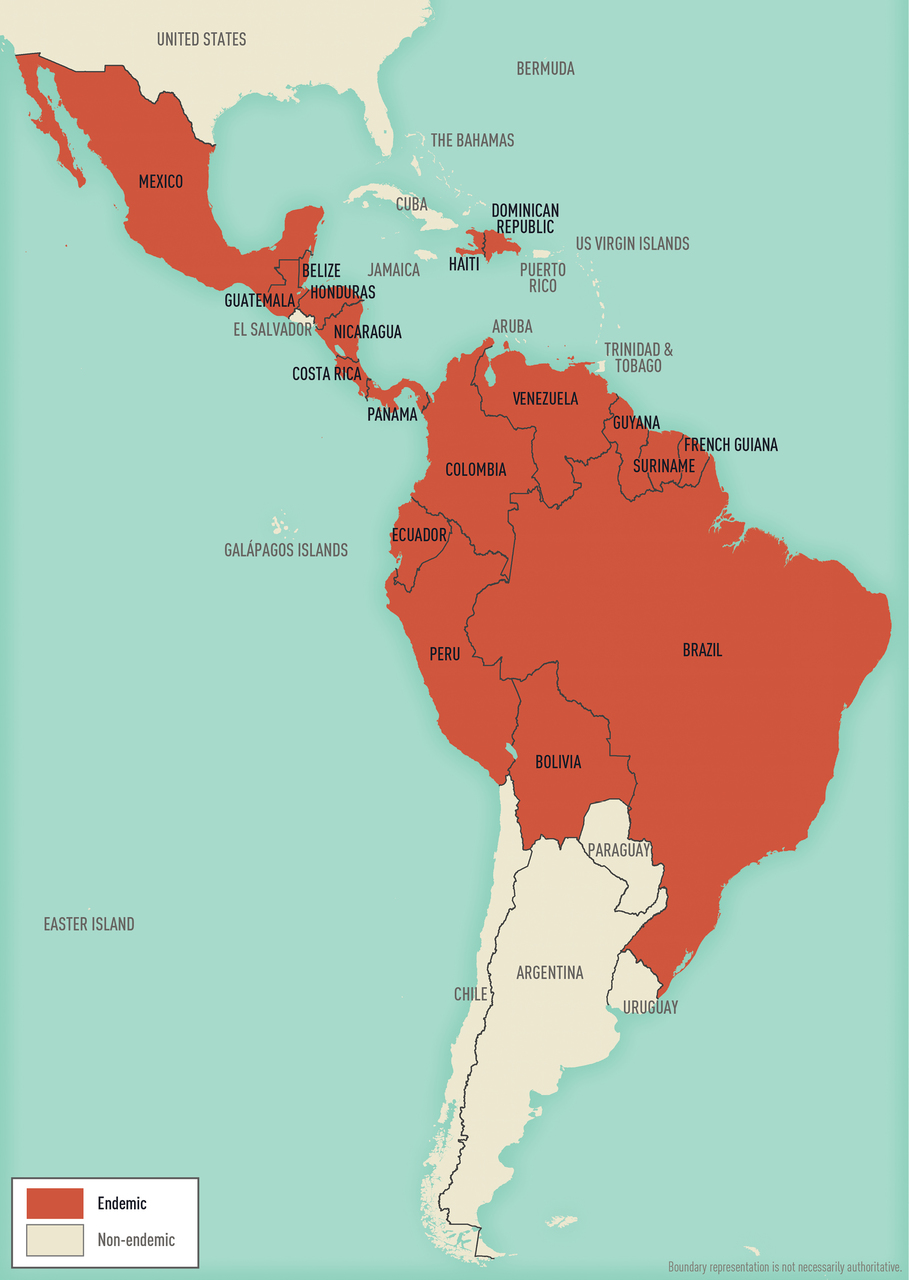
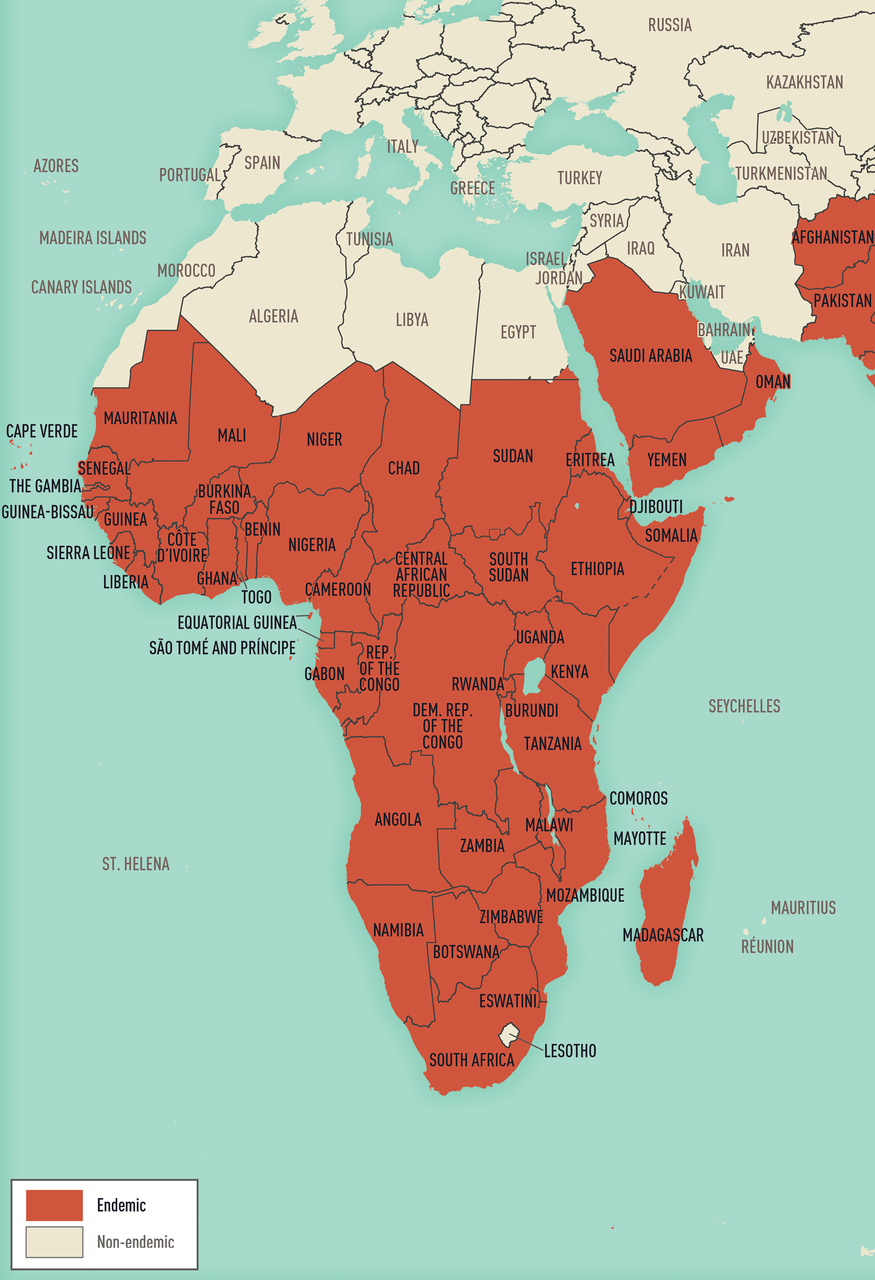
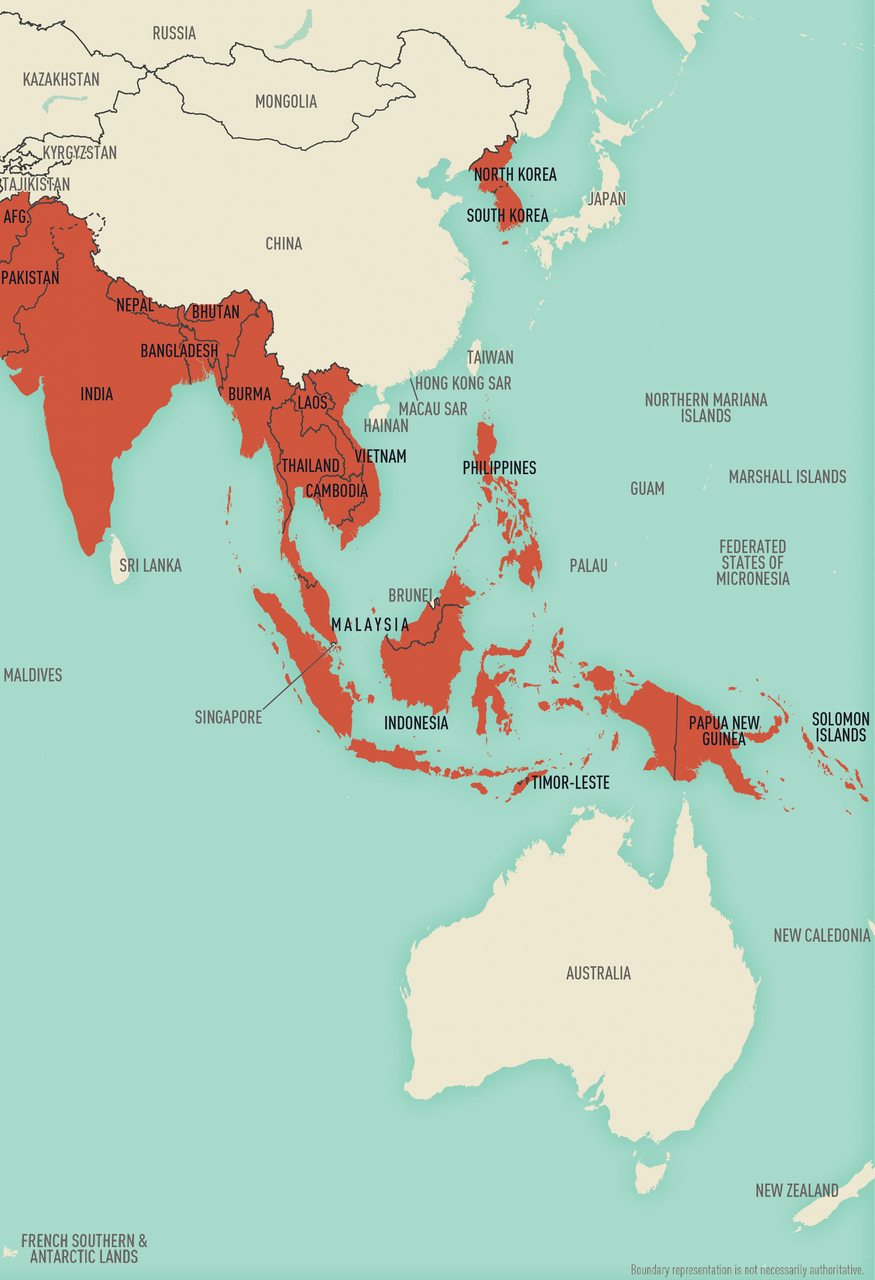
A sinistra, Paesi endemici per malaria nell'emisfero occidentale; a destra, Paesi endemici per malaria nell'emisfero orientale (Fonte: CDC Yellow Book 2024).
| World Malaria Report 2023 | ||
|
Nel World Malaria Report 2023, l'Organizzazione mondiale della sanità (Oms) riporta i dati relativi alla malaria nel 2022. Complessivamente si sono registrati 249 milioni di casi in 85 Paesi endemici per malaria, 5 milioni in più rispetto all'anno precedente. I principali paesi che hanno contribuito a questo incremento sono il Pakistan (2,1 milioni in più), l’Etiopia (1,3 milioni in più), la Nigeria (1,3 milioni in più), l’Uganda (597.000 in più) e Papua Nuova Guinea (423.000 in più). L’incidenza dei casi di malaria è diminuita da 81 per 1.000 abitanti a rischio nel 2000 a 57 nel 2019. Dopo un piccolo aumento del 3% nel 2020, i tassi di incidenza sono rimasti stabili negli ultimi 3 anni. Nel 2022, l’incidenza dei casi di malaria è stata di 58 su 1.000 abitanti a rischio. La percentuale di casi dovuti a Plasmodium vivax è diminuita da circa l'8% (20,5 milioni) nel 2000 al 3% (6,9 milioni) nel 2022. Ventinove paesi hanno segnalato il 95% dei casi di malaria a livello globale. Quattro paesi – Nigeria (27%), Repubblica Democratica del Congo (12%), Uganda (5%) e Mozambico (4%) – rappresentano quasi la metà di tutti i casi a livello globale. La regione africana dell'OMS, con una stima di 233 milioni di casi nel 2022, rappresentava circa il 94% dei casi a livello globale. La regione OMS del Sud-Est asiatico rappresenta circa il 2% dei casi di malaria a livello globale. I casi di malaria sono diminuiti del 76%, da 23 milioni nel 2000 a circa 5 milioni nel 2022. L’incidenza dei casi di malaria in questa regione è diminuita dell’83%, da circa 18 casi ogni 1000 abitanti a rischio nel 2000 a circa tre casi ogni 1000 abitanti a rischio nel 2022. Nel 2022, l'India rappresentava il 66% dei casi nella regione. Quasi il 46% di tutti i casi nella regione erano dovuti a P. vivax. Nella regione OMS del Mediterraneo orientale, tra il 2015 e il 2022 i casi di malaria sono aumentati del 92%, da circa 4 milioni a 8,3 milioni. Tra il 2021 e il 2022, la regione ha registrato un aumento del 25%, dovuto principalmente al forte aumento (2,1 milioni di casi di malaria) in Pakistan a seguito delle catastrofiche inondazioni che hanno colpito più di 30 milioni di persone. Nella regione OMS del Pacifico occidentale, il numero di casi di malaria è diminuito del 48% nel 2021, da 2,6 milioni di casi nel 2000 a circa 1,4 milioni di casi. Tra il 2021 e il 2022 si è registrato un aumento del 23%, raggiungendo 1,9 milioni di casi. Nello stesso periodo, l’incidenza dei casi di malaria è diminuita da quattro a due casi ogni 1.000 abitanti a rischio. La Papua Nuova Guinea ha rappresentato quasi il 90% di tutti i casi in questa regione nel 2022. Nella Regione OMS delle Americhe, i casi di malaria sono diminuiti del 64%, da 1,5 milioni a 0,6 milioni. L’incidenza dei casi è diminuita del 73%, da 13 a 4 casi su 1.000 abitanti a rischio tra il 2000 e il 2022. I progressi della regione negli ultimi anni sono stati penalizzati dal forte aumento della malaria in Venezuela, che ha registrato circa 35.500 casi nel 2000, arrivando a oltre 483.000 nel 2017. Nel 2020, tuttavia, i casi sono diminuiti di oltre la metà rispetto al 2019, a 223.000 casi; sono diminuiti ulteriormente nel 2021 e nel 2022, rispettivamente a 205.000 e 154.000 casi. I fattori che hanno contribuito a questa riduzione sono stati i bassi livelli di mobilità della popolazione derivanti dalle restrizioni pandemiche di COVID-19 e un aumento dei prodotti per la diagnosi e il trattamento della malaria. La regione europea dell’OMS è considerata "malaria free" ormai dal 2015. |
||
SITUAZIONE NELL'UNIONE EUROPEA-UE E SPAZIO ECONOMICO EUROPEO-SEE
I dati relativi alla casistica di malaria in Europa per il 2021, raccolti attraverso il Sistema di sorveglianza Tessy (The European Surveillance System), sono stati pubblicati a giugno 2023 nel report epidemiologico annuale per il 2021 dell’Ecdc. Il report segnala che nei Paesi dell'Unione europea e dell'Area Economica europea sono stati notificati 4.856 casi di malaria, di cui 4.855 confermati. Tredici casi confermati sono stati segnalati come acquisiti localmente (9 dalla Francia e 4 dalla Grecia). Questi dati sono poi stati aggiornati e riportati sul Surveillance Atlas of Infectious Disease, che a fine febbraio 2024 segnalava 4.862 casi per il 2021 e 6.131 casi per il 2022.
SITUAZIONE IN ITALIA
Come già riportato, la malaria ha imperversato nella Penisola per almeno duemila anni ma è poi stata eradicata con successo verso la metà del secolo scorso, tant'è che l'OMS ha dichiarato l'Italia libera dalla malaria solo nel 1970.
Nonostante ciò, ogni anno si registrano ancora qualche centinaio di casi e un paio di decessi. Si tratta quasi sempre di casi d'importazione e pertanto non bisogna smettere di promuovere le indicazioni sulla prevenzione da adottare in caso di viaggi in aree a rischio. Ma purtroppo, come ogni anno ci ricordano alcuni casi di cronaca, anche chi non si è mai mosso dall'Italia può, sebbene molto raramente, contrarre la malattia. Ciò può avvenire essenzialmente nei seguenti 4 modi.
- Malaria "da aeroporto": capita quando una zanzara infetta è stata chiusa accidentalmente in un volo proveniente da paesi endemici, sopravvive al viaggio (in cabina o altri scomparti pressurizzati) e ai trattamenti insetticidi (obbligatori) e una volta che l'aereo è atterrato e aperto questa può volar via, pungere e infettare un malcapitato soggetto presente nei paraggi. In Italia i voli da zone pericolose sono praticamente tutti concentrati a Malpensa e Fiumicino. Viaggi con altri mezzi (treni, natanti, automezzi) non possono, invece, portare zanzare vive da posti così remoti.
- Malaria "da bagaglio": analogamente al caso precedente, una zanzara infetta può viaggiare in un bagaglio a mano, in una gabbia per animali o in altri contenitori mantenuti a pressioni e temperature compatibili con la vita. In questo caso il soggetto colpito può trovarsi anche lontano dall'aeroporto di arrivo, poiché il bagaglio può essere trasportato un po' ovunque nel giro di poche ore.
- Malaria "autoctona" vera e propria: se una zanzara nostrana, competente, compie un pasto di sangue su di un soggetto infettatosi all'estero può a sua volta infettarsi e, se le condizioni sono favorevoli, trasmettere il plasmodio con un successivo pasto. La probabilità che ciò avvenga è molto bassa (si parla di meno di un caso ogni 10 anni in tutto il Paese) ma non è impossibile. All'interno di questa piccola possibilità, la probabilità maggiore ce l'ha P. vivax, che annovera ancora diversi vettori competenti tra le nostre zanzare. Molto minore, ma non pari a zero, quella degli altri plasmodi.
- Malaria "indotta": il plasmodio può anche essere inavvertitamente trasmesso da un paziente malato a uno sano, attraverso trapianti d'organo, trasfusioni di sangue o errate pratiche ospedaliere.
Per quanto riguarda il terzo punto (malaria autoctona) occorre ricordare che la fauna italiana comprende una quindicina di specie di zanzare del genere Anopheles, quasi tutte in grado di trasmettere almeno una forma di malaria, anche se la maggior parte come vettore secondario od occasionale. In molte aree, però, le specie storicamente presenti non sono più state catturate da molto tempo. Tre i vettori primari: An. labranchiae, An. atroparvus e An. sacharovi. La prima, un tempo vettore predominante soprattutto nell'area tirrenica, oggi è ancora presente in Toscana, Lazio, Sicilia, Sardegna, Calabria e Puglia. E' un buon vettore di P. vivax (terzana benigna) ed era in grado di veicolare i ceppi di P. falciparum (terzana maligna) un tempo presenti in Italia. Sembra, invece, essere refrattaria ai più comuni ceppi esotici del pericoloso parassita ma, secondo alcune prove di laboratorio, deve essere considerato come potenziale vettore di alcuni ceppi africani.
An. atroparvus era, invece, un tempo presente nella Pianura Padana, dov'era responsabile soprattutto della trasmissione di P. vivax. Sarebbe anche lei competente per i ceppi europei di P. falciparum ma non per quelli tropicali. Per molti anni non sono stati fatti studi per verificare distribuzione e consistenza della sua popolazione, studi complicati dal fatto che An. atroparvus appartiene a un complesso di specie morfologicamente indistinguibili, di cui 5 presenti in Italia. Recentemente (i dati sono in corso di pubblicazione), una ricerca condotta da Istituto Superiore di Sanità, Università di Roma Sapienza, Centro Agricoltura Ambiente di Crevalcore (BO), Istituti Zooprofilattici e Ipla SpA, su tutta la Pianura Padana, ha permesso di individuare An. atroparvus solo in due piccole aree: una al confine tra Lombardia e Veneto e l’altra presso le Valli di Comacchio. An. sacharovi era vettore primario di P. vivax sulla costa dell'alto Adriatico, secondario in Sardegna, dove non è più stato rinvenuto, e in Puglia, dove è stato recentemente ritrovato dopo oltre 50 anni dall'ultima segnalazione. Nel corso della recente ricerca citata prima, questa specie non è più stata trovata in Pianura Padana.
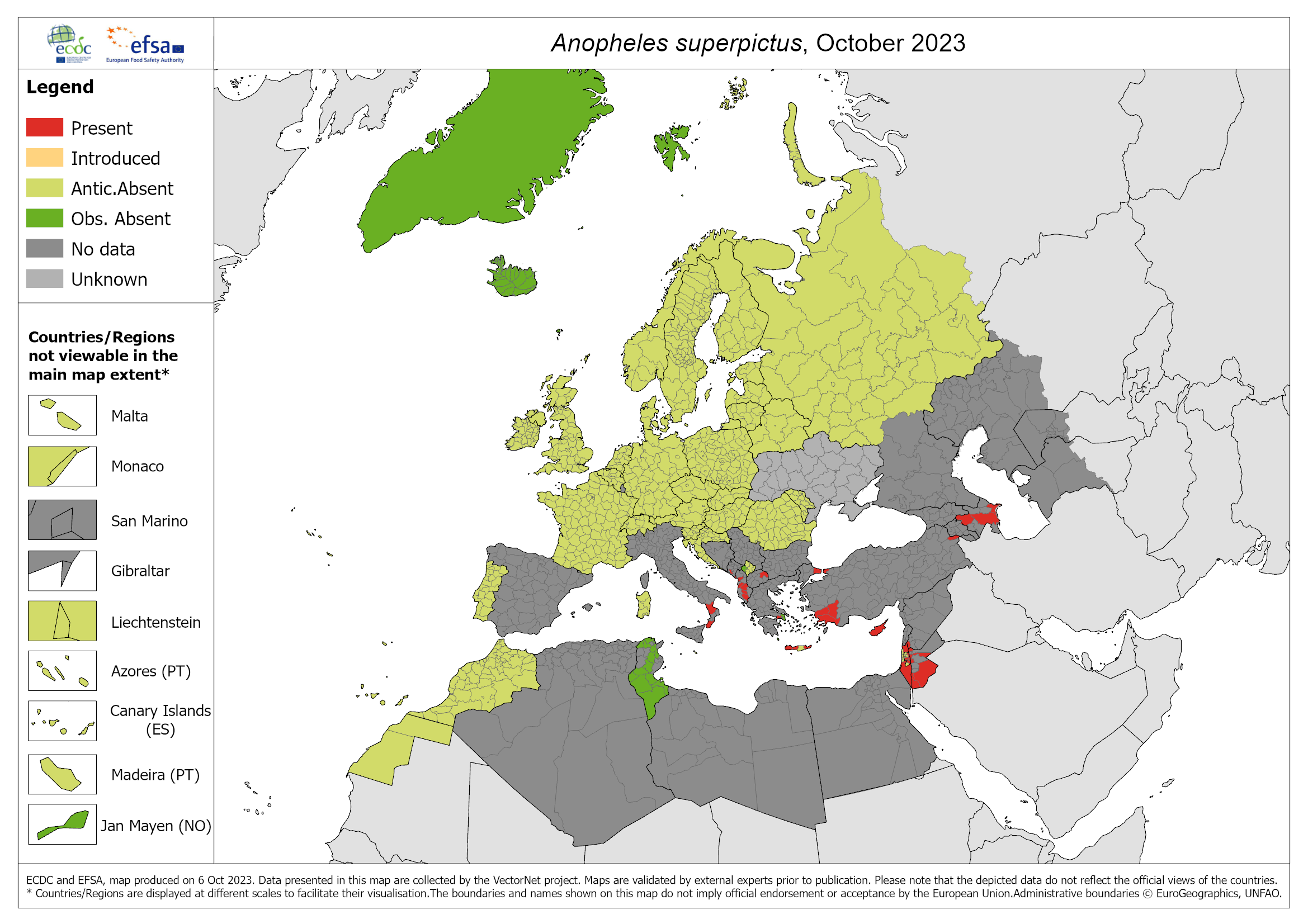
In Italia sono anche presenti zanzare che altrove rappresentano il vettore primario di P. vivax, come An. claviger (primario in Medio Oriente) e An. sergentii (primario in Nord Africa), ma con popolazioni e distribuzione tali da non suscitare preoccupazioni. Tra i vettori secondari (sempre di P. vivax), ricordiamo An. superpictus, ancora presente in varie regioni, tra cui Calabria e Sicilia, oltre che nei Balcani, An. messae, presente al nord e An. maculipennis, diffusa, ma poco antropofila. Queste due specie sono state recentemente trovate, insieme all'innocua An. melanoon, anche in Piemonte.
Le restanti specie sono molto rare o rappresentano solo vettori occasionali. Tra queste ultime, citiamo An. plumbeus, presente con una certa costanza anche in Piemonte, che si sviluppa nelle piccole raccolte d'acqua dei cavi degli alberi. La citiamo perché alcuni anni fa è stata identificata come possibile vettore di P. falciparum in due casi autoctoni di malaria in Germania. Perciò, pur non avendo mai assunto un ruolo preponderante nella diffusione della malattia in aree ed epoche di endemismi, può essere responsabile di casi sporadici legati all'introduzione di plasmodi nel sangue di pazienti provenienti da aree oggigiorno endemiche.
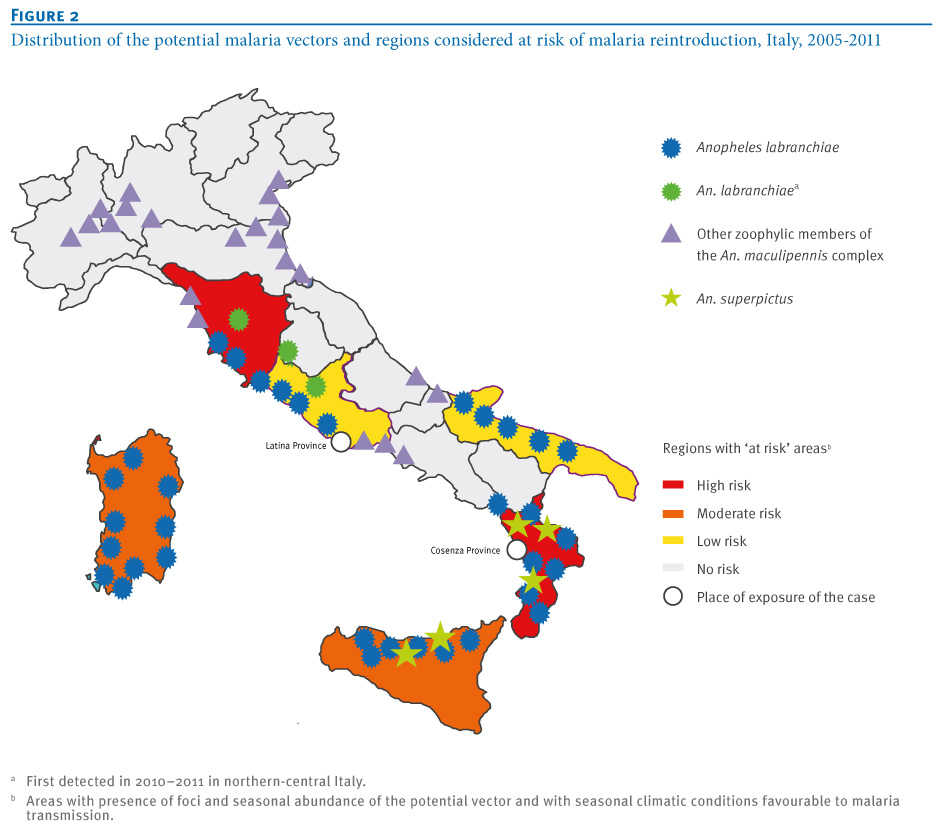
Distribuzione dei vettori potenziali della malaria in Italia e Regioni considerate a rischio di reintroduzione della malattia, Italia, 2005-2011 (fonte: Eurosurveillance 29 novembre 2012)
In Italia, tra il 2013 e il 2017 sono stati confermati 3.805 casi di malaria. Di questi, 12 sono risultati di origine autoctona di cui 7 si sono verificati nell'estate del 2017, in particolare: 4 erano casi indotti (causati da eventi accidentali quali trasfusioni o altra forma di inoculazione parenterale come trapianti, infezioni nosocomiali ecc.) e 8 considerati criptici poiché non è stato possibile stabilire l'esatta modalità e luogo di trasmissione. Sono stati segnalati 8 decessi, di cui 5 solo nel 2017 (Fonte: Epicentro - Il portale dell'epidemiologia per la sanità pubblica: aspetti epidemiologici in Italia).
Per maggiori informazioni, si consiglia la lettura delle seguenti pagine di questo Sito:
- note storiche sulla lotta alla malaria in Italia;
- note storiche sulla lotta alla malaria in Piemonte.
APPROFONDIMENTI
- Linee guida ministeriali per la prevenzione e il controllo della malaria in Italia.
Le ultime linee guida per la prevenzione e il controllo della malaria risalivano ormai a vent'anni fa. Il Ministero della Salute ha, perciò, ravvisato la necessità di fornire raccomandazioni aggiornate e ha a tal fine pubblicato, il 27 dicembre 2016, una nuova circolare con oggetto "Prevenzione e controllo della malaria in Italia".
| Ne forniamo, qui di seguito, un'ampia sintesi. | ||
|
La trasmissione della malaria in Italia fu interrotta grazie alla Campagna di Lotta Antimalarica attuata tra il 1947 e il 1951, anche se casi sporadici si sono ancora verificati in Sicilia fino agli inizi degli anni '60. Nel 1970 l'OMS include l'Italia tra i paesi indenni da malaria, tuttavia nel nostro Paese resta in vigore la notifica obbligatoria. Il Ministero della Salute e l'Istituto Superiore di Sanità mantengono attivo un sistema di sorveglianza che prevede una continua valutazione della situazione epidemiologica sia tramite l'elaborazione annuale della casistica sia attraverso il controllo dell'anofelismo residuo nelle aree in cui è ancora presente il vettore. La malaria è nel frattempo diventata la malattia tropicale più frequentemente importata per il crescente numero di viaggiatori internazionali e di flussi migratori da aree endemiche.
Tra i cittadini italiani si sono riscontrati il 20% dei casi, di cui il 41% di ritorno da viaggio di lavoro, il 22% per turismo, il 21% per volontariato/missione religiosa. Gli stranieri rappresentano il restante 80% dei casi. Oltre i quattro quinti di questi sono da registrarsi tra immigrati regolarmente residenti in Italia e tornati nel paese di origine in visita a parenti ed amici, definiti in letteratura come Visiting Relatives and Friends (VRFs). Solo il 13% dei casi è riscontrato tra immigrati al primo ingresso.
Se la risposta è affermativa a tutte le domande, c'è buona probabilità che si tratti di un caso di malaria autoctona introdotta, trasmesso da zanzare indigene. |
||
- Epidemiologia della malaria in Europa: Annual Epidemiological Report for 2020 - Malaria (ECDC).
Nel report epidemiologico annuale per il 2021, l'ECDC riporta i dati relativi alla malaria, raccolti attraverso il Sistema di sorveglianza Tessy (The European Surveillance System) e relativi all'anno 2021. - Epidemiologia della malaria nel mondo: World Malaria Report 2023 (OMS).
Nel World Malaria Report 2023, l'OMS riporta i dati relativi alla malaria nel mondo nel 2022. Per maggiori informazioni, consultare la pagina del sito dell'OMS che illustra brevemente il Report 2023 e l'app Global Malaria Program Toolkit che riunisce, in un'unica risorsa facile da navigare, il contenuto dell'ultimo rapporto mondiale sulla malaria e delle linee guida consolidate dell'OMS per la malaria, nonché i manuali operativi e gli altri documenti tecnici. - Verso un mondo libero dalla malaria: l’eradicazione in Uzbekistan (OMS).
Pubblicazione che descrive la storia della malaria nel paese asiatico dichiarato "malaria-free" nel 2018, portata come esempio per i paesi in cui si sta ancora combattendo la campagna per liberarsi dalla malattia. - Verso un mondo libero dalla malaria: verso l’eradicazione nella regione del grande Mekong (OMS).
Bollettino annuale del programma di eliminazione dalla malaria dalla regione del Mekong (Cambogia, provincia cinese dello Yunnan, Laos, Myanmar, Tailandia e Vietnam). - Verso un mondo libero dalla malaria: la recrudescenza in Kyrgyzstan (OMS).
Pubblicazione che descrive le ragioni della recrudescenza della malaria in Kyrgyzstan e delle politiche adottate per mantenere il paese libero dalla malaria. - Il documento "Allerta vettore: Anopheles stephensi invasione e diffusione in Africa e Sri Lanka" (OMS).
Questo documento sostituisce una versione precedente rilasciata nel 2019. Include nuovi dati sulla presenza del vettore e lezioni apprese negli ultimi anni, in particolare per quanto riguarda la sorveglianza. Fornisce inoltre ulteriori indicazioni ai programmi nazionali di controllo della malaria su risposte specifiche alla diffusione di An. stephensi in Africa, nonché dettagli tecnici su sorveglianza, analisi e reportistica. - Il documento "Linee guida dell'OMS per la malaria".
- Questo documento riunisce le raccomandazioni più aggiornate dell'OMS per la malaria.
- Il documento "Preparazione per la certificazione di eliminazione della malaria".
Questo documento fornisce una guida estesa sulla preparazione della certificazione ai paesi che si stanno avvicinando all'eliminazione della malaria. - La pagina internet "Paesi e territori certificati esenti da malaria (1955-2021)", che afferisce al Programma globale contro la malaria dell'OMS.
- La campagna "Raggiungere l'obiettivo zero malaria" (OMS).
In occasione della Giornata Mondiale della Malaria 2023, l'OMS promuove il tema "E' ora di raggiungere l'obiettivo zero malaria: investire, innovare, implementare" e mette a disposizione messaggi chiave e materiali per social media. - Il documento "Malaria eradication: benefits, future scenarios and feasibility" (OMS).
Dopo il suo studio triennale sulle tendenze e sulle proiezioni future per i fattori e le determinanti alla base della malaria, il Gruppo di consulenza strategica sull'eradicazione della malaria (SAGme) ribadisce che l'eradicazione è un obiettivo che vale la pena perseguire, probabilmente per salvare milioni di vite e miliardi di dollari. Tuttavia, con gli strumenti attuali, siamo lontani da un mondo privo di malaria.
Nella sua sintesi, SAGme chiede maggiori investimenti nella ricerca e nello sviluppo di nuovi strumenti e approcci per combattere la malaria, una copertura sanitaria universale più forte in modo che tutti possano accedere ai servizi di cui hanno bisogno e una migliore sorveglianza per guidare una risposta alla malaria più mirata.
Per maggiori informazioni, si consiglia di consultare il report "Malaria eradication: benefits, future scenarios and feasibility". - Il documento "A framework for malaria elimination" (OMS).
Nel 2017, a distanza di dieci anni dal precedente documento, l’OMS ha pubblicato una nuova guida, dal titolo "A Framework for malaria elimination", che delinea una serie di azioni politiche volte all’eradicazione della malaria nel mondo. Secondo i dati dell'OMS, nel 2015 i casi di malaria nel mondo sono stati 212 milioni e l'infezione ha causato circa 400 mila decessi. Nonostante tra il 2010 e il 2015 ci sia stata una diminuzione generale dell'incidenza della malattia e dei tassi di mortalità (rispettivamente del 21% e del 29%), la malaria continua a essere un importante problema di sanità pubblica. - La pubblicazione "Strategia tecnica globale per la malaria 2016-2030".
La strategia tecnica globale per la malaria 2016-2030 è stata adottata dall'Assemblea mondiale della sanità nel maggio 2015. Fornisce un quadro globale per guidare i Paesi nei loro sforzi per accelerare i progressi verso l'eliminazione della malaria. La strategia stabilisce l'obiettivo di ridurre l'incidenza globale della malaria e i tassi di mortalità di almeno il 90% entro il 2030. Sottolinea l'importanza di utilizzare dati di sorveglianza di alta qualità per il processo decisionale, individua le aree in cui soluzioni innovative saranno essenziali per il raggiungimento degli obiettivi e sintetizza i costi globali stimati di attuazione.
Per maggiori informazioni, si consiglia di consultare la pubblicazione "Global technical strategy for malaria 2016–2030". - Informazioni per i viaggiatori internazionali (OMS).
La pubblicazione dell'OMS, "Il viaggio internazionale e la salute" è una guida completa alla prevenzione e al trattamento di tutte le malattie che possono potenzialmente colpire i viaggiatori. Essa include informazioni sulla distribuzione geografica della malaria, dettagli epidemiologici per tutti i paesi con endemismo e tutte le misure preventive raccomandate; contiene, inoltre, raccomandazioni sulle misure protettive contro le punture di zanzara, i possibili effetti collaterali (anche gravi) derivanti dall'uso di vari farmaci contro la malaria e lo stato di resistenza ai farmaci antimalarici nei vari paesi.
Per maggiori informazioni, si consiglia di consultare il capitolo dedicato.
Documenti utili:
- Circolare Regione Piemonte Prot. n. 00029557: Sorveglianza speciale Malaria: aggiornamenti
- Regione Piemonte: Scheda per la notifica e l'inchiesta epidemiologica di caso di malaria
- Nota Regione Piemonte Prot. n. 1677 A1409A: Trasmissione Circolare ministeriale Prevenzione e controllo della Malaria in Italia e aggiornamento dei flussi informativi della sorveglianza epidemiologica a livello regionale
- Circolare ministeriale Prot. n. 0036391-27/12/2016: Prevenzione e controllo della Malaria in Italia
- Documento tecnico SIMET: Indicazioni per la profilassi antimalarica nei viaggiatori in area endemica - Revisione 2018
- Pagina del Ministero della Salute sulla profilassi della malaria
Articoli utili:
- Presenza e bionomica aggiornate di potenziali vettori di malaria in Europa: una revisione sistematica (2000-2021). 2022 (Parasites & Vectors).
Siti di riferimento nel Mondo
- Cdc e malaria. Pagine del sito dei Cdc dedicate alla malaria. Nel sito c'è inoltre una sezione dedicata agli avvisi sanitari relativi ai viaggi.
- Oms e malaria. Pagina del sito dell'Oms dedicata alla malaria.
- Paho e malaria. Pagine del sito della Pan American Health Organization dedicate alla malaria.
Strumenti
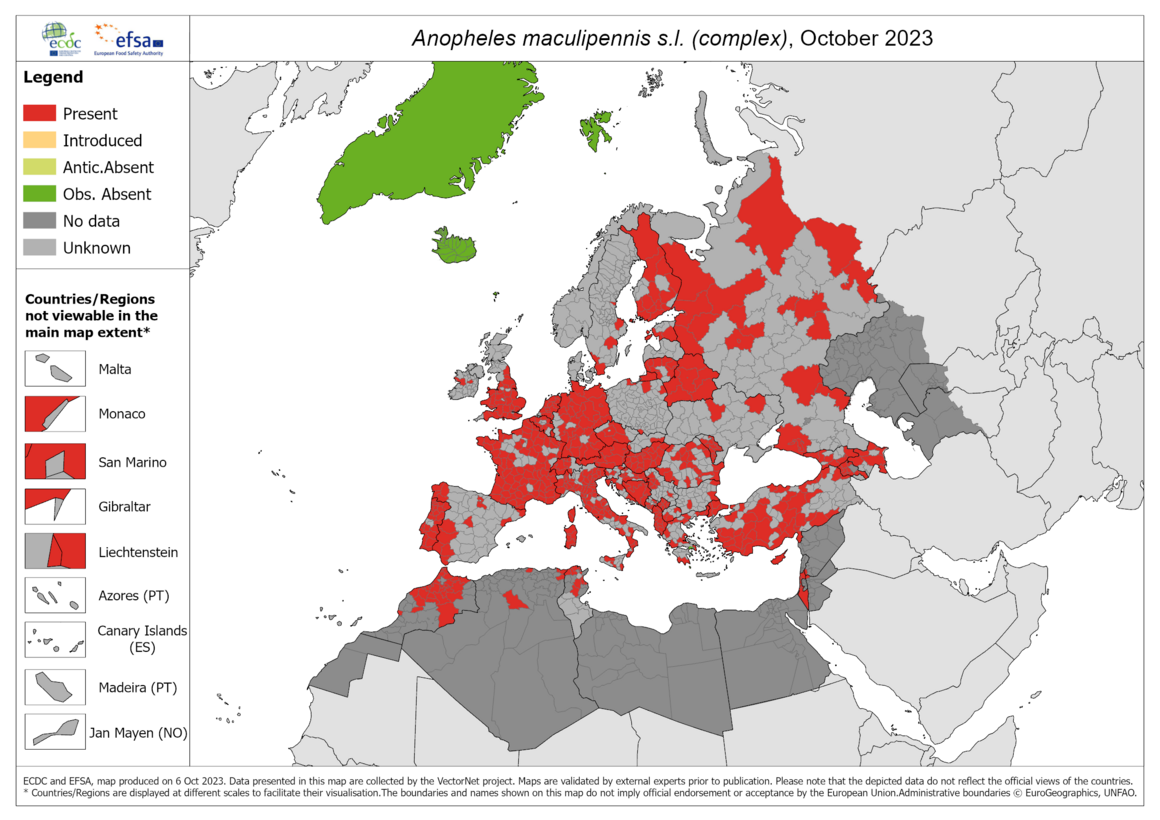
- Zanzare: le mappe di distribuzione Ecdc. Sul sito dell'Ecdc sono disponibili per operatori e cittadini le mappe di distribuzione delle zanzare (Vector Maps). L'obiettivo è fornire a decisori e popolazione informazioni aggiornate sulla diffusione di questi vettori mostrando anche il livello di distribuzione regionale.
 |
 |
GLOSSARIO DELLA PAGINA
A B C D E F G H I J K L M N O P Q R S T U V W X Y Z
Anofelismo residuo. Termine che identifica una situazione in cui, pur non essendoci più trasmissione malarica, persistono le condizioni entomologiche perché essa possa riprendere a causa della presenza di vettori competenti.
Pagina aggiornata a marzo 2024. Links verificati il 14 marzo 2024.





